Notre Expertise
Le CANCER DE LA PROSTATE
Dépistage et prise en charge du cancer de la prostate : le point à fin 2016
Paris, le 5 décembre 2016
• En France, comme dans la plupart des pays qui utilisent à bon escient le PSA, la mortalité par cancer de la prostate a chuté de manière spectaculaire depuis 20 ans. Cette baisse de la mortalité semble même s’accélérer puisque sur la période 2005-2011, on observe une diminution de 3,8 % par an, alors qu’elle n’est que de 0,8 % en moyenne sur la période précédente 1980-2005. L’Association Française d’Urologie ne peut que s’en réjouir. Néanmoins ce cancer tue près de 10 000 patients par an et il reste le premier en terme d’incidence chez l’homme. Il ne faut donc pas baisser la garde et continuer à faire progresser sa prise en charge et améliorer la qualité des soins.
10 points clés autour du dépistage et de la prise en charge du cancer de la prostate
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
En conclusion,

3 questions au Pr Thierry Lebret, président de l’AFU
Le surdiagnostic est un mot que je ne comprends pas, un diagnostic est basé sur une preuve histologique : il y a ou il n’y a pas de cancer. A l’opposé, on peut parler de sous ou de sur traitement si celui ci n’est pas adapté à la situation. Sur le dépistage et donc sur l’utilité du diagnostic, les études étaient, je dis bien étaient, divergentes. D’un côté le PLCO trial, réalisé aux Etats-Unis avait conclu que le dépistage n’apportait pas de bénéfice en terme de survie. Mais cette étude est maintenant complètement remise en question dans sa méthodologie car, avec le temps, les langues se sont déliées. En fait, à l’aide d’un questionnaire adressé à tous les patients, il s’est avéré que, plus de 80 % des patients du bras « non dépisté » ont eu un ou plusieurs dosages du PSA en dehors du cadre de l’étude. Cette constatation a fait l’objet d’une publication dans le New England Journal of Medecine en Mai 2016 et rend cette étude américaine complètement caduque… et sans valeur scientifique1.
De son côté, l’étude européenne ESRPC, qui porte sur 8 pays, arrive aux conclusions inverses. Elle objective un gain de survie de 21 % à 13 ans grâce à l’utilisation du PSA. Pour l’étude de Göteborg, ce gain en survie spécifique est établi à 42 %. Avec le temps la différence de survie entre la population dépistée et celle non dépistée s’accentue encore2. Le vrai problème concernant le PSA n’est donc pas tant de savoir si on fait trop de PSA, mais quel PSA et à qui ?
88 % des PSA pratiqués en France sont prescrits par le médecin généraliste. Dans l’immense majorité des cas ils sont réalisés dans le cadre d’un bilan de santé global de l’individu. Par ailleurs, 21 % de ces bilans mesurent le PSA libre qui n’est pas un indicateur pertinent. Enfin le nombre de PSA chez des patients très âgés qui n’en tirent aucun bénéfice reste trop élevé (33 % chez les hommes de 85 ans et plus) alors que toutes les recommandations, celles de la HAS comme celles de l’AFU, incitent à limiter la prescription de ces tests au-delà de 75 ans.
En l’espace de 5 ans, le nombre de prostatectomies a drastiquement diminué passant d’environ 27 000 à 18 000. La baisse continue à raison de 5 % par an. Il est probable qu’on s’achemine vers une optimisation des indications de cette intervention.
Néanmoins “moins de prostatectomies” ne doit pas être un objectif en soi. L’objectif est de mieux traiter. La notion d’espérance de vie est aujourd’hui un élément clef pour déterminer le mode de prise en charge. Il est communément admis qu’il convient de traiter « agressivement » le cancer des patients âgés de moins de 75 ans car leur espérance de vie est supérieure à 10 ans. En France la prostatectomie totale est principalement pratiquée chez des patients jeunes (48,6 % chez les 50-54 ans, 40,3 % chez les 65-69 ans). Au-delà de 70 ans, l’opération devient beaucoup plus rare. L’étude Delpierre et alii3 conclut que le vrai problème n’est pas tant de mieux cibler les patients à qui l’on fait un PSA que de disposer des outils pour évaluer l’état de santé général des patients et leur espérance de vie résiduelle.
Il ne faudrait pas qu’en dépistant moins et en réalisant moins d’ablations de la prostate on en arrive paradoxalement à augmenter la proportion de patients diagnostiqués à un stade métastatique. Les études épidémiologiques montrent en effet que dans les pays où le PSA ne se pratique pas en routine, les cancers diagnostiqués au stade métastatique sont 4 à 8 fois plus nombreux. Or non seulement ces cancers sont de très mauvais pronostic, mais les traitements entraînent des effets secondaires sévères (troubles de la sexualité, obésité et diabète, syndrome métabolique…).
L’AFU plaide pour une information des hommes dès 45 ans et un premier dosage vers 45 ans pour les patients à risque et 50 ans pour les autres. En fonction du résultat de ce premier dosage et de l’appartenance ou non à un groupe à risque, l’urologue proposera soit de cesser pour un temps les PSA, soit d’en refaire un tous les 2 ans, soit enfin de suivre de manière plus régulière (une fois par an) l’évolution du PSA. Il ne s’agit donc pas de faire un dépistage à l’aveugle mais sur des populations ciblées et bien informées. Ce PSA doit s’accompagner d’un examen clinique qui reste indispensable.
En matière de diagnostic, les principaux progrès que nous attendons nous viennent de l’imagerie et de l’anatomopathologie. Les IRM sont aujourd’hui et seront de plus en plus performants pour nous indiquer l’agressivité d’une tumeur et donc décider du choix d’une chirurgie radicale, d’une méthode moins invasive ou d’une simple surveillance active. De même, de nouveaux marqueurs sont en cours de développement qui aideront de façon considérable à la décision thérapeutique (index Phi, 4K, PCA3, Prolaris, Oncotype…). L’objectif étant, une fois encore, de proposer la solution optimale adaptée à chaque patient.
En ce qui concerne les technologies actuellement disponibles, la chirurgie reste la référence. La curiethérapie et la radiothérapie, les ultra-sons de haute intensité (ablatherm total) sont également validées. La cryothérapie qui consiste à “congeler” la tumeur et l’ablatherm focal sont en cours d’évaluation. Quant à la photothérapie (destruction par la lumière), les premiers travaux ont pour le moment montré l’existence d’effets secondaires dans 82 % des cas dont 9 % d’effets graves. C’est une technique qui reste en évaluation.
En chiffres
8 713 décès par cancer de la prostate en 2015
Le cancer de la prostate reste la troisième cause de mortalité par cancer chez l’homme mais cette mortalité est en baisse constante depuis 1990 (-26 % en 15 ans ou -1,34 % par an).
Le décès survient en moyenne à 85 ans.
+ 22 % c’est le gain en survie en l’espace de 25 ans
Un tiers des patients sont sans traitement (34,1 % en 2014)
48,6 % des patients jeunes se voient proposer une prostatectomie mais seulement 24,8 % des patients de 70 à 74 ans et 4,5 % des patients de 75 à 79 ans
30 % des hommes de plus de 40 ans ont eu un PSA en 2011 (chiffre stable depuis 2009), 26,9 % en 2014 et 28,9 % en 2015
Les cas graves de cancer de la prostate diagnostiqués sont passés de 7 000 en
2001 à 5 000 en 2008 témoignant de l’efficacité du diagnostic précoce.
Les calculs urinaires
Apres le traitement les mesure de preventions permette d’eviter les recidives
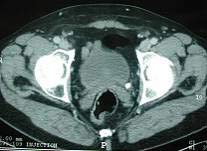
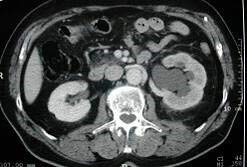
DIAGNOSTIQUE
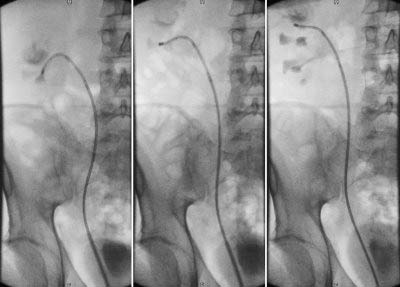
permet de confirmer le ou les calculs dans le rein ou l’urètre
(l’échographie permet de diagnostiquer les signes indirect tel que la dilatation des cavités rénales mais est moins précis pour voir les calculs)
leucocyte et CRP pour la recherche d’infection, calcémie et acide urique pour rechercher la cause de la fabrication des calculs
- ECBU pour la recherche d’une infection urinaire associéé
TRAITEMENT ENDOSCOPIQUE
elle est posée par endoscopie sous anesthésie générale et permet aux urines de ne pas être bloquées entre le rein et la vessie
permets de faire une chirurgie mini-invasive du calcul de l’urètre, sous anesthésie générale en utilisant une fibre laser au contact du calcule (laser Holmium ou laser Thullium)
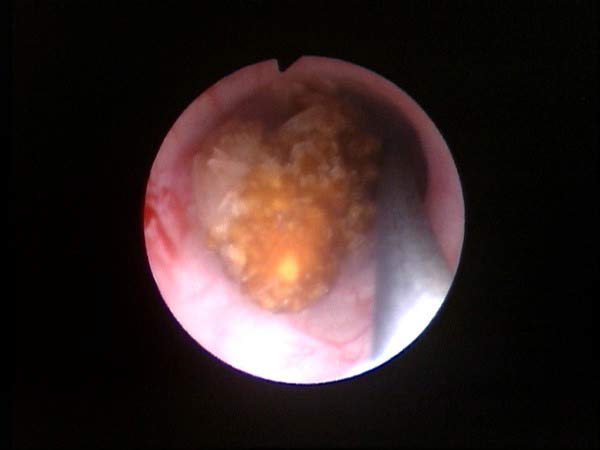
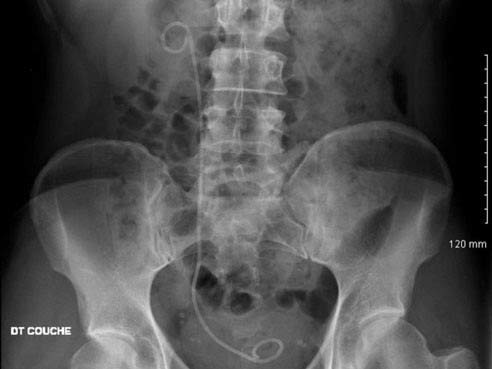

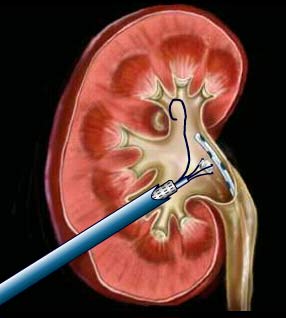
permet une chirurgie mini-invasive du calcul du rein ou de l’urètre en utilisant une fibre laser au contact du calcul (laser Holmium ou laser Thullium)
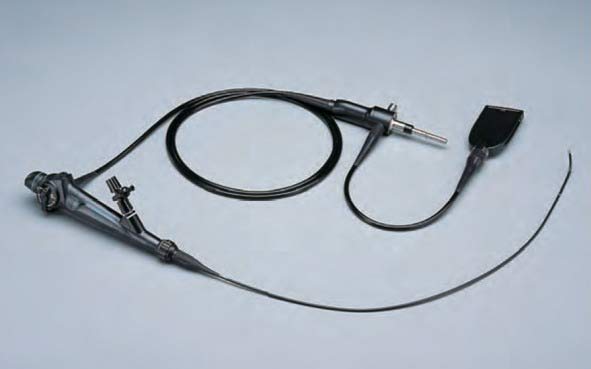
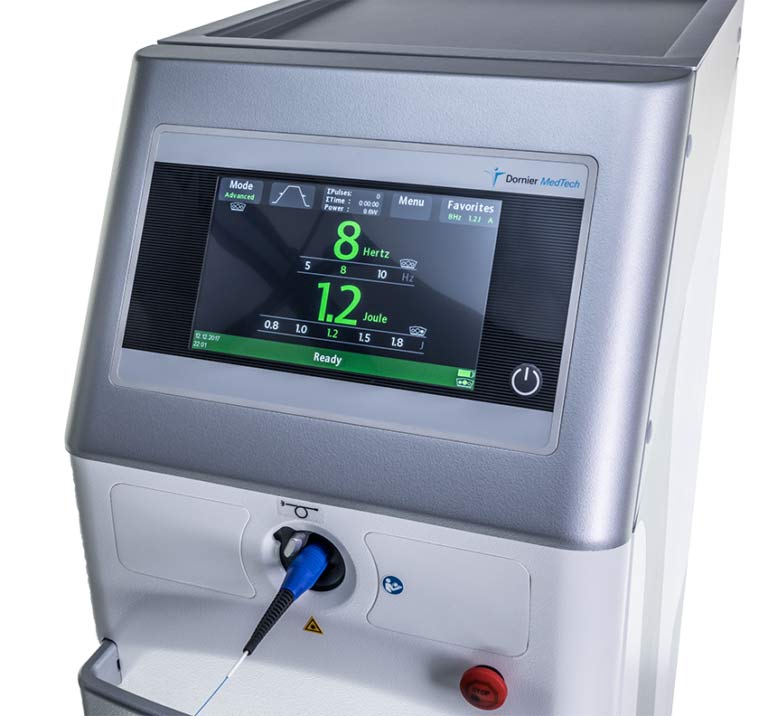
permets de traiter les volumineux calculs du rein sous anesthésie générale
Traitement par ultrasons du calcul sous anesthésie générale
PROLAPSUS
Définition du prolapsus génital
On inclut habituellement dans les prolapsus génito-urinaires la descente de la vessie ( cystocèle ), de l’utérus (hystérocèle) du rectum (rectocèle), le tout pouvant s’extérioriser par le vagin.
Epidémiologie
Il est cependant certain que les prolapsus représentent une pathologie fréquente et souvent gênante, mais pour laquelle il existe des solutions efficaces.
Types de prolapsus
- Le prolapsus vésical ( de la vessie) ou cystocèle,
- Le prolapsus utérin ( de l’utérus) ou hystérocèle,
- Le prolapsus rectal (du rectum) ou rectocèle.
- La cystocèle ( descente de la vessie) est, de loin, le prolapsus le plus fréquent.
Mécanismes des prolapsus
– la grossesse et les accouchements,
– l’âge avec la ménopause,
– la toux,
– la constipation chronique,
– l’obésité
– La présence de fibromes ou de tumeurs pelviennes
– Le port d’objets lourd
– Certaines pathologies génétiques
– Antécédent de chirurgie pelvienne
– Certaines pathologies neurologiques ou lésions de la moelle épinière
Symptômes des prolapsus
Les symptômes les plus fréquents sont :
En cas de cystocèle :
sensation de boule à la vulve,
gêne ou sensation de lourdeur du périnée,
difficulté à uriner avec jet faible et sensations de mal vider la vessie,
envies fréquentes et/ou impérieuses d’uriner,
infections urinaires à répétition ( causées par une mauvaise vidange de la vessie).
En cas d’hystérocèle:
C’est principalement la boule à la vulve qui provoque une gêne.
Dans certains cas évolués, la muqueuse extériorisée peut être irritée, provoquer des petits saignements, voire être ulcérée et/ou infectée. Ces cas sont devenus rares.
En cas de rectocèle :
La sensation de boule à la vulve peut bien sûr être présente,
Mais ce sont surtout les symptômes d’origine rectale qui sont présents: constipation, difficultés pour aller à la selle, petites fuites de matière fécale,
Les examens complémentaires
Il est habituel de pratiquer un examen cyto-bactériologique des urines (ECBU) à la recherche d’une infection urinaire.
Un examen urodynamique peut être demandé afin de clarifier les problèmes de vessie et/ou de sphincter urinaire, si nécessaire.
Dans certains cas complexes (comme les récidives après chirurgie), il peut être utile de s’aider d’un colpocystogramme (examen de radiologie où l’on opacifie les organes pelviens avant de faire des clichés au repos et en poussée), ou d’une IRM pelvienne.
Le traitement du prolapsus génital
En effet, selon le type de prolapsus, l’importance des symptômes, l’âge et les antécédents de la patiente, il sera choisi un traitement différent. Dans certains cas, aucun traitement ne sera proposé, si le prolapsus est modéré et très peu gênant.
Lorsqu’une intervention chirurgicale est décidée, deux types de procédures peuvent être réalisées
Elle est réalisée par cœlioscopie 3 D et permet d’amarrer les organes descendus à l’aide d’une prothèse en polypropylène fixée à un ligament très solide en avant des vertèbres. Cette intervention est fréquemment associée à la pose d’une prothèse sous l’urètre, afin de traiter ou d’éviter l’apparition de fuites urinaires à l’effort.
Plus d’informations sur la promonto-fixation coelioscopique.
Elle est habituellement proposée aux patientes les plus âgées ou ayant une contre-indication à la chirurgie par voie abdominale ou à la cœlioscopie. Cette technique peut s’accompagner ou non de la pose d’une prothèse de renforcement et d’une ablation de l’utérus si nécessaire. Là aussi il est possible d’associer la pose d’une bandelette sous l’urètre afin d’éviter ou de traiter une incontinence urinaire.
https://www.urofrance.org/sites/default/files/49_prolapsus_organes_pelviens_par_voie_basse.pdf
Le choix de la voie abdominale ou vaginale dépend des éléments indiqués ci-dessus mais aussi de l’expérience du chirurgien , de ses habitudes et lorsque cela est possible, du choix éventuel de la patiente.
LES TUMEURS DE VESSIE
Les Tumeurs de vessie n’infiltrant pas le muscle vésical ( TVNIM) :
– Le traitement de première intention est conservateur : résection endoscopique souvent associé à un traitement adjuvant par instillations de chimiothérapie et ou d’immunothérapie.
– Un risque élevé de récidive qui impose une surveillance systématique. Le mode standard de surveillance reste la cystoscopie.
Sur le plan pronostique, cet ensemble de tumeur est hétérogène. Le risque de progression vers une tumeur invasive potentiellement létale est très variable. Les facteurs pronostiques reconnus sont essentiellement le stade et le grade tumoral. La cystectomie peut être envisagée dans les tumeurs à haut risque, en cas d’échec du traitement conservateur.
Dans notre centre nous réalisons les cystoscopies souples en consultation sous anesthésie locale, dans une salle dédiée. Nous utilisons des endoscopes souples, vidéo numérique avec un système NBI ( Narrow Band Imaging) qui permet d’améliorer la détection des tumeurs par leur hyper vascularisation.
Le traitement chirurgical permet par voie endoscopique l’ablation de ces tumeurs superficielles sous anesthésie générale au cours d’une hospitalisation généralement courte.
https://www.urofrance.org/sites/default/files/109_resection_trans-urethrale_de_vessie_0.pdf
Les instillations intra vésicales de chimiothérapie ou d’immunothérapie sont réalisées en soins externe dans un service dédié de l’établissement.
https://www.urofrance.org/sites/default/files/106_instillation_de_mitomycine_c.pdf
https://www.urofrance.org/sites/default/files/105_instillations_intra-vesicales_de_bcg_.pdf
Les Cancers de Vessie
La chimiothérapie peut alors être administrée avant la chirurgie (néo-adjuvante), en complément de la chirurgie (adjuvante), en alternative à la chirurgie dans le cadre de traitements multimodaux, et enfin seule à visée palliative en cas de cancer métastatique.
La fonction rénale du patient et son état général aident à la prise de décision et du choix du protocole de chimiothérapie qui devra être validé en réunion de concertation pluridisciplinaire et exposé au patient au cours d’une consultation d’annonce médicale et paramédicale.
https://www.urofrance.org/base-bibliographique/role-de-la-chimiotherapie-dans-le-cancer-de-la-vessie
La chirurgie qui consiste en l’ablation de la vessie et de la prostate chez l’homme (cystoprostatectomie totale) et des organes génitaux chez la femme ( pelvectomie antérieure) reste une intervention lourde laquelle il faut reconstruire un système pour l’évacuation des urines :
- soit par une reconstruction vésicale : Néovessie ou entérocystoplastie
- soit par une dérivation cutanée : une poche
https://www.urofrance.org/sites/default/files/96_derivation_urinaire_externe_type_bricker.pdf
https://www.urofrance.org/sites/default/files/84_enterocystoplastie.pdf
L’INCONTINENCE URINAIRE DE LA FEMME
DEFINITION (ICS 1976)
CLASSIFICATION : 3 types d’incontinence
- L’incontinence d’effort (IUE): perte d’urine involontaire survenant lors d’une augmentation de la pression abdominale : éternuement, toux, marche.
- L’incontinence par impériosité (ou instabilité vésicale): perte d’urine par envies pressantes non maîtrisables en rapport avec une contraction de la vessie.
- L’incontinence mixte : association d’une incontinence d’effort et d’une incontinence par instabilité vésicale.
1- L’incontinence urinaire d’effort :
Il n’y a habituellement pas de fuites nocturnes
Les causes les plus fréquentes sont liées à l’accouchement, et aux efforts répétés (toux chronique, constipation, sport…).
Le traitement est d’abord Médical :
Rééducation périnéale : 12 à 15 séances
Kinésithérapie avec Biofeed back et Electrostimulation
Ses Objectifs : Renforcement sangle musculaire périnéale et Acquisition du réflexe de verrouillage périnéal à l’effort
Traitement hormonal substitutif local.
Le traitement chirurgical :
– La pose d’une bandelette de soutènement sous urétrale par voie rétropubienne (TVT) ou transobturatrice (TOT)
Il s’agit d’une chirurgie très efficace qui est réalisée le plus souvent en ambulatoire, mais qui nécessite sa validation en réunion de concertation pluridisciplinaire de pelvi-périnéologie (Recommandation HAS oct 2020) .
– La mise en place d’un sphincter artificiel
https://www.urofrance.org/sites/default/files/51_sphincter_urinaire_artificiel_chez_la_femme_0.pdf
2- L’incontinence par impériosité mictionnelle :
Elle est souvent lié à une infection urinaire ( syndrome de cystite) ou à une
- irritation vésicale par une tumeur de vessie, un calcul, ou une infection de voisinage.
- Il faut enfin rechercher une Maladie Neurologique.
- Le traitement reste médical, tout d’abord il faut traiter la cause (infections urinaire, déficit hormonal, facteurs irritatifs…), des médicaments sont efficaces: les anticholinergiques, (leurs effets secondaires sont fréquents: bouche sèche et constipation)
- On peut également utiliser la toxine botulique (BOTOX) pour diminuer la contraction vésicale.
Il existe enfin une possibilité de Neurostimulation du nerf tibial postérieur ou de neuro-modulation des racines sacrées par implantation d’un PaceMaker.
- En conclusion, l’Incontinence urinaire n’est pas une fatalité, plusieurs mécanismes sont possibles, et il existe des traitements adaptés.
ADENOME DE PROSTATE
HBP (Hypertrophie Bénigne de la Prostate)
L’ adénome de la prostate, appelé également hypertrophie bénigne de la prostate ou hyperplasie bénigne de la prostate (HBP) correspond à l’augmentation de volume de la glande. C’est la tumeur bénigne la plus fréquente chez l’homme.
Le traitement est alors médical (Phytothérapie, alpha bloquants ou médicaments inhibiteurs de la 5 alpha réductase).
Après échec du traitement médical, plusieurs types de prise en charge chirurgicale sont possibles, l’objectif étant le même, enlever l’adénome de la prostate :
· Soit par voie ouverte : L’adénomectomie voie haute (AVH)
· Soit par les voies naturelles : résection trans-uréthrale de prostate (RTUP
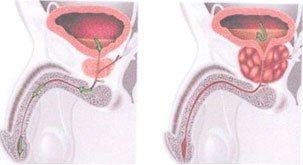
Prostate normale et Hypertrophie bénigne de la prostate
La Résection endoscopique
Nous utilisons soit la résection classique monopolaire, soit de façon plus fréquente la résection bipolaire Olympus avec un système d’énergie Plasma qui a l’avantage de diminuer les risques de saignement, et de permettre de prendre en charge les patients porteur de Pace Maker.
Ce système permet également de réaliser des énucléations prostatiques.
Le LASER
Il existe plusieurs type de laser pour les tissus, en urologie les laser HOLMIUM (technique HOLEP) et THULIUM sont les plus utilisés.
Le laser permet soit une vaporisation du tissu prostatique, soit une énucléation de la glande.
https://youtu.be/V6-YFS00nwc
Ces nouvelles techniques d’énucléation ou de vaporisation soit par le système plasma, soit par la technique Laser, permettent de diminuer des saignements per et post opératoire, de diminuer la durée de sondage et donc de diminuer le temps d’hospitalisation.

Laser Thullium
Le cancer du rein
Le cancer du rein se classe au 3e rang des cancers urologiques. Il est le plus souvent découvert de façon fortuite sur un examen d’imagerie (échographie ou scanner abdominal) réalisé pour un autre motif. Les symptômes, tels que la douleur lombaire ou le saignement urinaire sont absents au début de la maladie. Les hommes sont deux fois plus touchés que les femmes.
Les facteurs de risques sont le tabagisme, l’obésité, l’hypertension artérielle et l’insuffisance rénale chronique. Les formes héréditaires sont très rares.
Au contraire des kystes du rein, la grande majorité des tumeurs rénales solides sont malignes. Le type histologique du cancer du rein le plus fréquent est le carcinome à cellules claires (75%)
Le diagnostic, suspecté sur l’échographie abdominale, le scanner abdominopelvien ou l’IRM, est confirmé après la chirurgie d’exérèse de la tumeur. Toutefois, une biopsie percutanée (à travers la peau) peut être indiquée dans certains cas avant l’intervention chirurgicale. Un bilan d’extension de la maladie par scanner thoracique permet de rechercher d’éventuelles métastases.
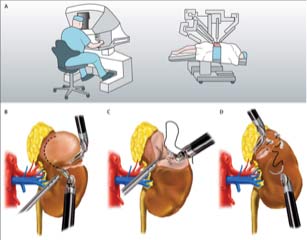
Le traitement de référence du cancer du rein est chirurgical. Son objectif est de réaliser l’ablation de la tumeur, idéalement en conservant le reste du rein. Il s’agit alors d’une néphrectomie partielle, réalisée par voie cœlioscopique robot assistée. Dans certains cas, les caractéristiques de la maladie imposent l’ablation complète du rein porteur de la tumeur. Il s’agit de néphrectomie totale élargie, réalisée par voie coelioscopique le plus souvent.
Les traitements ablatifs (radiofréquence ou cryothérapie principalement) sont des alternatives consistant en la destruction de la tumeur avec une énergie thermique. Une biopsie percutanée préalable est nécessaire afin de confirmer la nature maligne de la tumeur. Ces traitements sont réservés aux petites tumeurs du rein et concernent des patients âgés, aux multiples antécédents médicaux, pour qui la chirurgie est contre-indiquée.
https://www.urofrance.org/sites/default/files/62_nephrectomie_partielle.pdf
https://www.urofrance.org/sites/default/files/63_nephrectomie_totale.pdf

Contactez-nous
Vous avez des questions ?
NOUS TROUVER
Polyclinique Saint Privat
12 rue de la Margeride
34760 - BOUJAN sur LIBRON
www.polyclinique-saintprivat.fr
Horaires d'ouvertures
8h-12h | 13h-18h

